Rumus Penurunan Tekanan Uap – Pernyataan yang benar tentang tekanan uap suatu larutan adalah tekanan uap suatu larutan berbanding lurus dengan fraksi mol pelarut.
Sifat kolektif larutan adalah sifat larutan yang bergantung pada jumlah zat terlarut dalam larutan elektrolit dan larutan non-elektrolitik. Ketika zat terlarut dan pelarut dicampur, sifat kimia zat terlarut akan sedikit berubah, namun sifat fisik berubah dengan cepat bila dicampur. Berdasarkan hal tersebut dapat disimpulkan bahwa sifat koligatif larutan tidak bergantung pada jenis zat terlarut. Apa sifat koligatif suatu larutan?
Rumus Penurunan Tekanan Uap
Tekanan uap jenuh adalah tekanan uap yang dihasilkan oleh uap jenuh suatu zat ketika kondisi kesetimbangan telah tercapai. Sedangkan tekanan yang ditimbulkan oleh uap air jenuh disebut tekanan air jenuh. Penurunan tekanan uap jenuh larutan (∆P) merupakan selisih antara tekanan air jenuh minyak murni (Po) dan tekanan air jenuh larutan (P).
Lkpd Penurunan Tekanan Uap Activity
Pada tahun 1830-1901, menurut hukum Raoult, tekanan uap larutan sama dengan tekanan uap jenuh minyak murni dikalikan fraksi mol minyak. Sedangkan penurunan tekanan uap larutan sama dengan tekanan uap air jenuh pelarut murni dikalikan fraksi mol zat terlarut.
Karena sifat koligatif larutan, peningkatan jumlah zat terlarut akan menurunkan tekanan uap air larutan. Tekanan uap suatu larutan adalah tekanan uap larutan pada keadaan setimbang. Zat dengan tekanan uap yang tinggi berarti mudah bergerak. Zat dengan tekanan uap rendah berarti sulit dihilangkan.
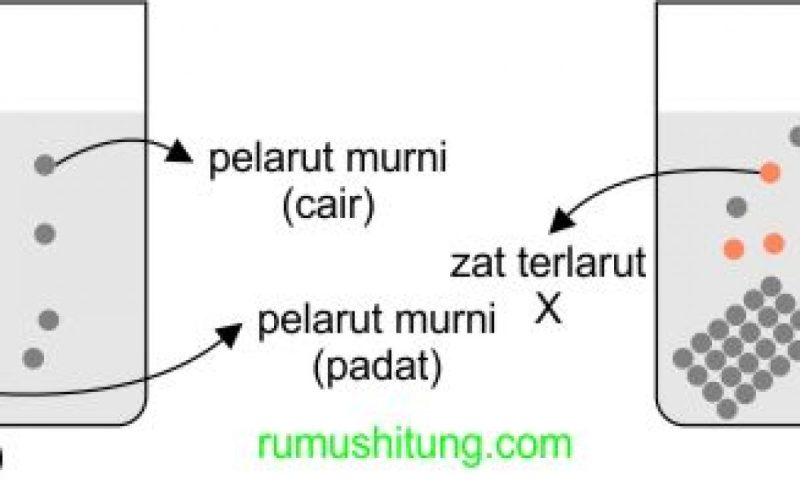
Bahan dalam keadaan uap akan menciptakan tekanan yang disebut tekanan uap. Dibandingkan dengan pelarut murni, tekanan uap larutan yang zat terlarutnya tidak mudah menguap akan lebih rendah dibandingkan tekanan uap pelarut murni. Larutan mempunyai banyak sifat koligatif yang keberadaannya dipengaruhi oleh banyaknya partikel dalam larutan. Salah satu sifat koligatif larutan adalah penurunan tekanan uap. Semakin banyak jumlah partikel dalam larutan maka semakin rendah tekanan uap larutan. Informasi ini sesuai dengan informasi dalam hukum Raoult, yang dapat ditemukan pada persamaan berikut.
Dari persamaan tersebut terlihat bahwa semakin besar perubahan tekanan uap maka semakin rendah tekanan uap larutan. Perubahan tekanan uap/penurunan tekanan uap sebanding dengan jumlah fraksi mol zat terlarut, sehingga dapat dikatakan bahwa dengan semakin kecilnya fraksi mol zat terlarut (jumlah partikel terlarut) maka tekanan uap larutan semakin berkurang. .
Pernyataan Tentang Tekanan Uap Jenuh Larutan Yang Benar Adalah
Pertanyaan baru dalam aplikasi kimia exo dan endo, apa pendapat orang cloud tentang proses kimia!! Dok, bagaimana solusinya jika cat minyak berbahan alkid yang banyak mengeluarkan uap saat kering? pertanyaan : nyatakan akibat/akibat masalah dan keadaan pangeran… ip kimia hijau Tekan tombol F5 pada keyboard untuk memulai/menjalankan program Gunakan/gerakkan mouse hingga muncul tanda panah Tekan karakter untuk memulainya Setelah masuk layar menu, pilih/klik salah satu menu Klik ikon untuk melanjutkan Klik ikon untuk kembali ke layar sebelumnya Klik ikon untuk kembali ke menu utama Pelatihan ini diberikan dalam 3 X sesi (6 X 45 menit) Sisa pelajaran , Selamat… Mulai selanjutnya Kembali ke Rumah
Menjelaskan sifat-sifat larutan, cara pengukuran dan kegunaannya Dasar: Menjelaskan molaritas, molalitas, fraksi mol Menjelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku dan tekanan osmotik. Oleh Sunarto Sulkan, SPd.
4 Ekspresi: Hitung molaritas, molalitas, fraksi mol Jelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku dan tekanan osmotik. Hitung penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik
7 Molaritas (M) Molaritas (m) Fraksi mol (Xt dan Xp) adalah pernyataan konsentrasi atau konsentrasi suatu larutan yang secara jelas menunjukkan jumlah mol zat terlarut dan jumlah mol pelarut.
Tentukan Penurunan Tekanan Uap Jenuh Larutan 10% Masa Glukosa C6h12o6 Dalam Air. Jika Diketahui Tekanan
8 Fraksi mol adalah pernyataan tentang konsentrasi suatu larutan, yang menyatakan perbandingan antara jumlah mol zat terlarut dengan jumlah mol komponen larutan (jumlah mol pelarut + jumlah mol zat terlarut) Fraksi mol garam Fraksi mol zat terlarut Jumlah mol minyak
12 Sifat komposit adalah sifat yang bergantung pada jumlah partikel suatu zat tertentu, bukan pada jenis partikelnya. Contohnya larutan HCl 0,1 M, larutan NaOH 0,1 M, larutan glukosa 0,2 M mempunyai molaritas yang berbeda-beda tetapi mempunyai sifat koligatif yang sama dengan larutan karena mempunyai jumlah partikel zat terlarut yang sama.
17 SOAL PRAKTEK 1. Bagaimana 3 mol elektrolit M2Z dilarutkan dalam 2 kg air sehingga mengalami ionisasi pertama sebesar 70% dan ionisasi kedua sebesar 20%. Tentukan titik didih larutan tersebut!
18 2. Larutan X yang membeku pada suhu -1,543oC mengandung 16 gram zat. Diketahui larutan Mr : 98, Kf : 1, 86oC/m. Tahukah Anda jika solusinya berbeda? Jika ya, tentukan laju ionisasinya!
Kenaikan Titik Didih Dan Penurunan Titik Beku
19 3. Untuk mengetahui rumus asam oksalat hidrat, karena 25,2 gram asam oksalat hidrat dilarutkan dalam 500 ml air, ternyata larutan mempunyai titik didih 100,520C. Jika asam terionisasi 75%, kd air: 0,520C/m. Tentukan rumus kristalnya! (Ar H:1 C:12 O:16)
4. Sebanyak 25,5 gram AgNO3 (Mr: 170) dalam 500 ml air dicampur dengan 36,5 gram HCl (Mr: 36,5) dalam 1000 ml air. Tentukan titik beku larutan setelah pencampuran! (Lih. air: 1,860C/m)
21 1. M2Z MZ- + M+ 3 2, 1 2, 1 2, 1 0, 9 2, 1 2, 1 MZ- M+ + Z2- 2, 1 0, 42 0, 42 0, 42 1, 68 0,42 0,42 mol tersisa = 5,52 mol
22 2. ∆ Tf = – 1,543 gram t = 16 gr ∆ Tf = 1,543 gram p = 500 gr 1, 543 = 16 x 100 x 1,86 x I ,543 = 16, 87, I 0 = 20 , 0,
Lembar Kegiatan Peserta Didik (lkpd) Sifat Koligatif Larutan
∆ Td = 0,52 α = 0,75 0,52 = 25,2 x 1000 x 0,52 x (1+(2-1) 0,75) Tuan Tuan = 126 ( ) + 10x = 126 x = 2
24 4. t1 = 25,5 gr p1 = 500 ml t2 = 36,5 gr p2 = 1000 ml ∆ Tb = 25,5 x 1000 x 1, 0,5 x 1000 x 1+ (2-1) 1 x 1, 86, = 4 °C Tb = 0 – 4,278 = – 4,278 °C
Agar situs web ini berfungsi, kami mencatat data pengguna dan membaginya dengan proses. Untuk menggunakan situs web ini, Anda harus menerima kebijakan privasi kami, termasuk kebijakan cookie kami. Penghilangan tekanan uap merupakan salah satu bahan kimia yang harus dipahami. Kekuatan uap suatu larutan dapat berkurang karena beberapa faktor.
Air adalah suatu titik di udara tempat air membeku. Pengertian lain dari steam adalah suatu gas yang terbentuk akibat air yang mengalami proses pemanasan.
Penurunan Tekanan Uap
Tekanan uap adalah tekanan yang terjadi pada suatu gas di atas air ketika ditutup. Tekanan uap terjadi ketika cairan dan gas berada dalam kesetimbangan.
Pengertian penurunan tekanan uap adalah perbedaan tekanan suatu larutan dengan pelarut murninya. Dalam hal ini, tekanan yang terjadi pada uap adalah partikel-partikel zat tersebut.
Sifat larutan yang menguap adalah koligatif. Artinya, ia hanya bergantung pada partikel terlarut, bukan jenis partikel zat dalam larutan.
Uap tekanan tubuh berhubungan dengan seberapa mudah minyak dihilangkan. Sederhana atau tidaknya tergantung pada gaya tarik menarik yang terjadi antar partikel itu sendiri.
Cermati Diagram P T Pada Gambar 1.7. Diagram Terse
Pada tekanan uap yang terjadi pada pelarut murni maka akan terjadi perpindahan partikel dari fasa cair ke fasa gas. Terakhir, terjadi kesetimbangan dengan perpindahan partikel dari fasa gas ke fasa cair.
Jika larutan berwarna putih dimasukkan ke dalam wadah tertutup maka akan terjadi pergerakan partikel. Sejumlah partikel murni dalam fase gas dapat memberikan tekanan.
Tekanan ini disebut tekanan uap. Setelah beberapa waktu, partikel pembersih akan mulai terpisah. Ketika kondisi ini terjadi maka terjadilah keseimbangan dinamis.
Anda dapat menghitung perkiraan tekanan uap minyak murni menggunakan hukum Raoult. Salah satu penerapan hukum Raoult adalah dengan menggunakan metode viskositas.
Bunyi Hukum Raoult
Selama larutan tidak kental, zat terlarut tidak mudah dihilangkan. Sedangkan minyaknya jangan mudah menguap.
Jumlah udara dalam larutan akan sedikit jika gaya tarik menarik yang timbul antar partikel lebih kuat dibandingkan dengan partikel sejenis (garam dan zat terlarut).
Contoh penurunan tekanan uap dapat kita lihat pada aktivitas sehari-hari, misalnya pada saat merebus air panas, mie goreng kilat, dan lain-lain. (R10/HR-Online) JENIS LARUTAN -> Campuran homogen antara 2 zat atau lebih. Larutan yang berbahan dasar listrik : Z. Zat terlarut terionisasi dan tak terionisasi Larutan yang dapat menghantarkan listrik Larutan tidak menghantarkan listrik Contoh : asam, basa, garam selain A, B, G, contoh : gula, alkohol, urea Zat terlarut ) Pelarut (minyak) Larutan elektrolit Tidak ada larutan elektrolit
Terionisasi sempurna, derajat ionisasi (α) = 1 Reaksi searah: HCl H + + Cl- Tidak ada keseimbangan elektrolit lemah: terionisasi sebagian, derajat ionisasi: 0 < α < 1 Reaksi terarah: HF H F- Dalam kesetimbangan tetap ( baca berturut-turut tentang)
Sifat Sifat Koligatif Larutan
DENGAN CARA INI: Suatu zat terlarut bereaksi secara kimia dengan minyak untuk menghasilkan zat baru, zat terlarut membentuk senyawa dengan minyak, suatu larutan didasarkan pada dispersi saja.
Konsentrasi suatu larutan secara kuantitatif menggambarkan komposisi perbandingan antara zat terlarut dan pelarut. Ada beberapa cara untuk menyatakannya: molaritas (molalitas) Fraksi mol (X) Persen (%) Bagian per juta (ppm)
Penjelasan: L = liter larutan mL = mililiter larutan g = gram zat terlarut (massa) Mr = massa molar zat terlarut
Penjelasan: kg = kg minyak (massa) p = gram minyak (massa) g = gram zat terlarut (massa) Mr = massa molar zat terlarut
Memahami Rumus Kenaikan Titik Didih Suatu Larutan
ITU AMAN
Rumus penurunan titik beku, rumus penurunan tekanan uap larutan, contoh soal penurunan tekanan uap, rumus tekanan uap larutan, rumus tekanan uap jenuh, rumus tekanan uap air, penurunan tekanan darah, tekanan uap, pengertian penurunan tekanan uap, penurunan tekanan darah tinggi, soal penurunan tekanan uap, contoh soal kimia penurunan tekanan uap