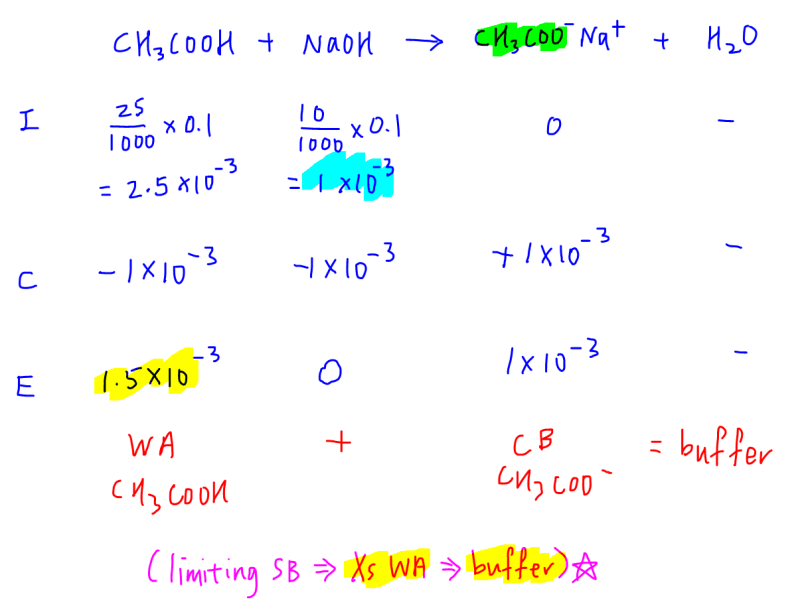Ph Ch3cooh – Lab ini mendemonstrasikan penentuan pH @ titik ekivalen dan nilai konsentrasi total (M) (keduanya tidak diketahui) untuk lemah (asam asetat) dan kuat (asam klorida) menggunakan pH meter dan software data logging.
Jauh dari titrasi dan titrasi, titrasi menentukan kekuatan standar atau derajat konsentrasi suatu larutan. Dan dipecah secara etimologis,
Ph Ch3cooh
Berasal dari akar kata “titrer”, Perancis “standard, title” dan “-ate”, yang berarti “keadaan atau kualitas (adj.)”. Jadi dalam titrasi, seseorang secara harfiah mengukur molaritas suatu zat dengan membakukannya dengan zat lain. .
What Is The Component Concentration Ratio, [ch3coo ]/[ch3coo
Untuk alasan ini, selama titrasi, satu larutan yang diketahui sering dituangkan ke dalam larutan lain dengan konsentrasi yang diinginkan dan tidak diketahui. Solusi datang dalam pasangan asam-basa, jadi ketika sudah siap, itu bukan asam atau basa hiperkonsentrasi, tapi air. Mengenai keasaman, titik akhir titrasi dapat ditentukan dengan mengamati warna larutan yang ditandai dengan indikator. pH indikator yang diinginkan sangat mirip dengan pH @ titik ekivalen larutan yang akan dititrasi (yaitu, jika EQ pH = 9, gunakan indikator pH ~9). Pada titik ekivalen, larutan titrasi sepenuhnya menetralkan yang diinginkan jika terjadi peningkatan atau penurunan pH yang tiba-tiba dan tajam. Dalam semua kasus, dataran pH yang sangat rendah atau tinggi mengikuti titik ekivalen. Dan untuk kombinasi asam kuat-basa kuat, titik ini mendekati 7. Namun, saat titrasi asam atau basa lemah, titik EQ bisa turun mendekati 8-9 (asam yang lebih lemah memiliki pH awal yang tinggi) atau 5-6 (basa yang lebih lemah memiliki pH awal yang lebih rendah).
Pencapaian penting lainnya di sepanjang perjalanan titrasi, setengah kesetaraan hadir seperti namanya. Ini menunjukkan subperiode reaksi ketika setengah dari yang dibutuhkan (larutan yang diketahui) ditambahkan ke yang tidak diketahui. Karena yang tidak diketahui akan semi-netral, buffer sempurna dapat ada (asam mol = mol gabungan basa atau basa = gabungan asam).
Jika seseorang melintasi titik ekivalen dan indikator telah menukar warna bening aslinya dengan warna oranye atau merah muda yang serasi (warna tergantung pada jenis dan pH indikator), matematika memasuki persamaan. Mengetahui persamaan reaksi seimbang, konsentrasi yang tidak diketahui dapat dihitung berdasarkan volume titrasi dan molaritas titrasi. Data volumetrik dan molar terakumulasi selama proses dan nantinya dapat diubah menjadi plot V (mL ditambahkan, sumbu x, variabel bebas) dan pH (1-12, sumbu y, variabel terikat [dikumpulkan secara eksperimental]). Contoh grafik terlihat seperti ini:
Titrasi menawarkan penggunaan yang sangat praktis dan mendasar, meskipun sering diabaikan, di dunia modern. Contoh dari praktik medis termasuk pemberian cairan intravena (darah versus obat tambahan) dan pemantauan glukosa darah. Dalam industri makanan, kandungan asam lemak tak jenuh, asam lemak bebas, vitamin C dan E, gula, garam dan air produk potensial ditentukan dengan titrasi. Selain itu, pemelihara akuarium laut dan air tawar menggunakan titrasi untuk memantau pH air dan konsentrasi nitrit, nitrat, dan amonium. Bahkan produsen biodiesel mengandalkan data titrasi saat menyesuaikan keasaman limbah!
The Ph Of 0.01 M Solution Of Acetic Acid Is 5.0. What Are The Values Of [h^+] And Ka Respectively?
Namun, kita mulai dengan upaya yang lebih sederhana: dengan titrasi dengan natrium hidroksida 0,1 M, kita menentukan pH pada titik ekivalen larutan asam klorida dan asam asetat. Berikut adalah persamaan kimia terkait dan seimbang:
Titik pengambilan data V/pH – Asam asetat dititrasi dengan natrium hidroksida Mililiter NaOH Ditambahkan: pH larutan CH3COOH: 0 3,47 3,5 4,05 6 4,46 9,3 15 45 45 45 . 01 16 7.20 16.8 10.10 17 10.93 18 11.12 19 11.40 20 11.61 23 ~12 25 ~12 27 ~12 29 ~12 Titik pengumpulan data V/pH – Asam klorida dititrasi dengan natrium hidroksida Mililiter NaOH yang ditambahkan: pH larutan HCl: 0 2,10 2 2 2 2 2 2 4 5 . .26 7 .2 2.34 7.9 A.4 8.37 14.8 10 .2 15.3 10.71 15.5 10.91 16 11.07 16.4 11.2 17 11.31 19 11.53 21 11.73 32 pH (12.08) )
CH3COOH (aq) + H2O (l)↔ H3O+ (aq) + CH3COO- (aq) HCl (aq) + H2O (l)→ H3O+ (aq) + Cl- (aq)
2. Buat gambar mikroskop dari kedua asam tersebut sebelum dititrasi. Anda dapat mewakili ion hidrogen dan anion yang terbentuk dalam larutan dengan lingkaran berwarna berbeda.
Ph Larutan Ch3cooh 0,2 M ( Ka = 2×10* 5) Adalah..
Grafik untuk kedua spesies termasuk puncak pH titrasi asam asli, dan pH untuk kedua spesies turun karena lebih banyak NaOH yang ditambahkan kemudian dalam percobaan. Namun, kurva titrasi HCl jauh lebih curam dan netralisasi terjadi jauh lebih awal daripada CH3COOH.
HCl, sebagai asam kuat, terdisosiasi lebih banyak dalam air daripada asam lemah CH3COOH. Oleh karena itu, larutan HCl mengandung lebih banyak ion H+ daripada larutan CH3COOH; sehingga pH akhir HCl akan lebih tinggi.
Pada setengah titik ekivalen (setengah titrasi), semua asam harus dinetralkan. Sebaliknya, tepat setengah dari tanda lahirnya terpisah dan membentuk basis konjugasi. Menurut definisi, buffer sempurna mengandung asam yang bereaksi dengan ion hidroksida apa pun dan basa yang menyerap hidrogen, menahan perubahan pH. Keduanya akan memiliki molaritas yang sama di tengah titrasi.
Penyelesaian laboratorium matematika dan juggling konseptual yang spektakuler ini benar-benar mencapai tujuannya. Kami telah berhasil menghitung molaritas asam asetat dan larutan asam klorida yang sebelumnya tidak diketahui hanya dengan menggunakan indikator, air suling, 0,1 M NaOH dan perangkat lunak perekam. Pengumpulan data dikontrol dengan cermat dan teratur; ujung yang longgar sebagian besar tidak mengganggu. Selain itu, saya tidak hanya memahami dasar-dasar grafik titrasi, tetapi juga memperluas pengalaman teknologi saya ke Logger Pro 3.9, program analisis yang lebih profesional yang akan meningkatkan akurasi dan konten ilmiah dari eksperimen saya di masa mendatang.
Find The Ph Obtained By Mixing 250ml ,0.2m Ch3cooh And 200ml 0.1 M Naoh Given Pka Of Ch3cooh =4.74 Log3=o.48
Namun, satu perspektif yang meragukan tentang eksperimen ini dan kemungkinan kelemahannya sangat mencolok: saya tidak hadir di lab itu sendiri. Saya menugaskan mitra saya, Andrew Smith dan Michael Richman, untuk menuliskan hasil kami dan menjalankan percobaan. Sebagai imbalannya, saya akan mengelola meja – dengan mengorbankan kemungkinan kecelakaan atau kesalahan perhitungan yang tidak dapat saya cegah secara fisik. Terlepas dari itu, produk akhir kami terdaftar dengan cukup baik, yang menunjukkan bahwa mereka adalah yang terbaik, dan saya yakin tidak ada kesalahan besar di pihak kami. Singkatnya, apa yang lab ini tidak berikan kepada saya dalam hal pengalaman langsung dengan titrasi tingkat lanjut, ini dibuat untuk formula latar belakang dan praktik organisasi data.
N ch3cooh, ch3cooh nh4oh, naoh ch3cooh, ch3cooh, asam cuka ch3cooh, ch3cooh termasuk elektrolit karena, asam asetat ch3cooh, ka ch3cooh, harga ch3cooh, msds ch3cooh science lab, msds ch3cooh, koh ch3cooh