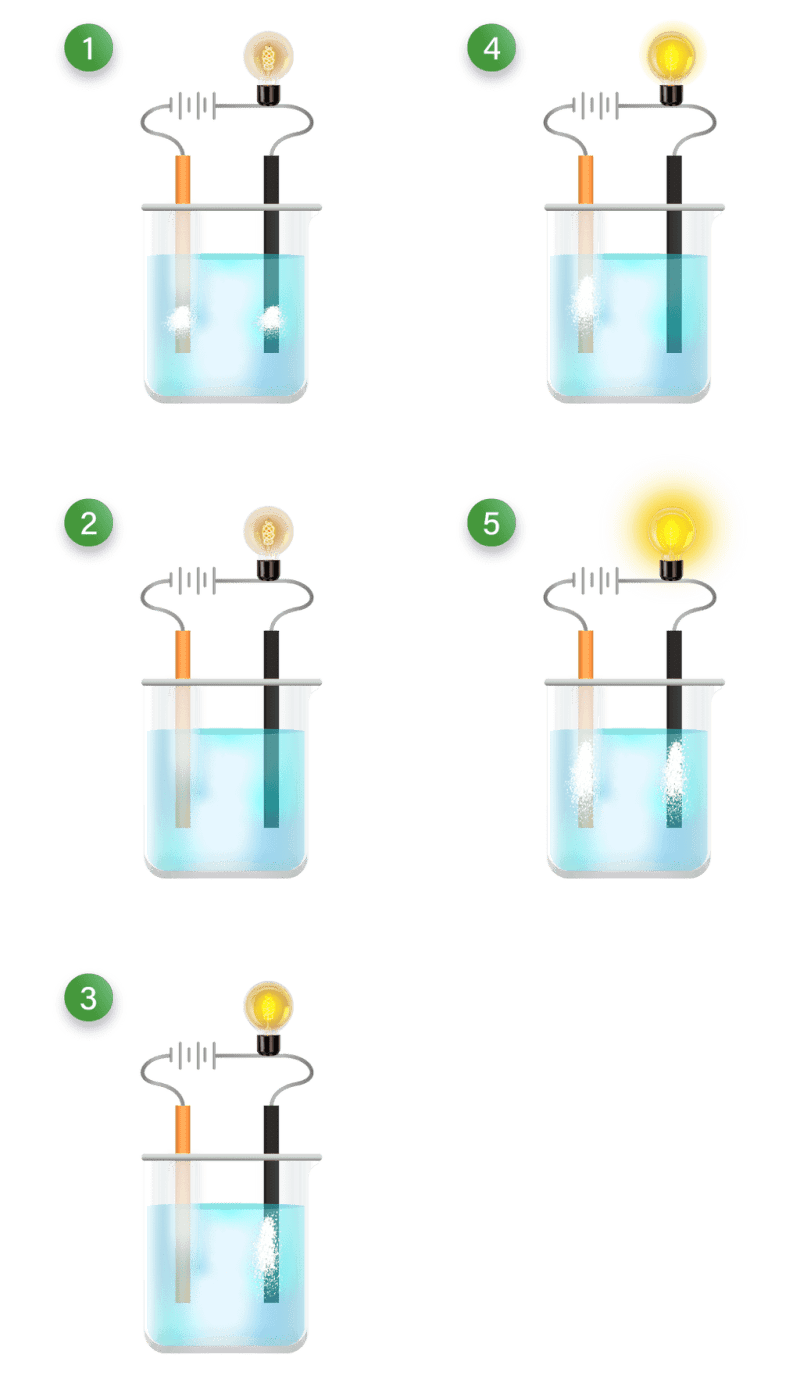
Berikut Ini Yang Merupakan Larutan Elektrolit Adalah – Berhati-hatilah saat menguji sifat elektrolit larutan berikut. Pasangan larutan yang mengandung elektrolit kuat dan non-elektrolit masing-masing ditunjukkan dengan angka….
Pembahasan Jawaban yang benar adalah E. Percobaan Uji Konduktivitas Listrik: Larutan elektrolit kuat menghasilkan nyala api yang terang benderang dan banyak muncul gelembung gas. Larutan elektrolit lemah menghasilkan bola lampu yang lemah atau mati dan muncul gelembung gas kecil. Larutan tanpa elektrolit tidak akan menyalakan lampu dan tidak terbentuk gelembung gas. Jika dilihat pada gambar, elektrolit kuat nomor 5 dan non-elektrolit nomor 2. Oleh karena itu, sepasang larutan yang mengandung elektrolit kuat dan non-elektrolit masing-masing diwakili oleh angka (5) dan (2).
Berikut Ini Yang Merupakan Larutan Elektrolit Adalah
Jika dilihat pada gambar, elektrolit kuat nomor 5 dan non-elektrolit nomor 2.
Larutan Berikut Yang Merupakan Pasangan Elektrolit Kuat Dan Non Elektrolit Secara Berturut Turut Yaitu A.
Dalam satu percobaan, diperoleh data berikut. Kekuatan larutan elektrolit yang tidak sesuai data adalah… 4 4.7 Jawaban Terverifikasi
Jika diperiksa dengan penguji elektrolit, larutan etanol tidak menghasilkan nyala api yang tajam. Apabila diuji dengan indikator lakmus, larutan etanol tidak mengubah warna kertas lakmus merah atau biru. Berdasarkan… 37 4.9 Jawaban Terverifikasi
Di bawah ini adalah tabel data terkait konduktivitas listrik. Pernyataan yang benar tentang elektrolit adalah zat yang bila dilarutkan dalam air… 48 5.0 Jawaban Terverifikasi
Data uji daya hantar listrik larutan berikut. Dari data tersebut dapat disimpulkan bahwa : Larutan 1 merupakan elektrolit kuat. Larutan 2 dan 3 merupakan larutan non-elektrolit… 2 5.0 Jawaban Terverifikasi Pernahkah anda mendengar istilah larutan elektrolit dan larutan non-elektrolit? Penasaran kenapa listrik bisa mengalir di air? Nah, fenomena tersebut merupakan salah satu fenomena yang berkaitan dengan contoh larutan elektrolit.
Lengkapilah Peta Konsep Di Bawah Ini!
Atau mungkin Anda pernah merasa saat rumah Anda terendam banjir, lampu atau listrik di rumah Anda mati oleh PLN? Sekali lagi karena ini berkaitan dengan sifat larutan elektrolit dan non elektrolit.
Ternyata banyak fenomena dalam kehidupan yang berkaitan dengan larutan elektrolit dan non elektrolit. Tapi apa sebenarnya yang dimaksud dengan larutan elektrolit dan non-elektrolit?
Jika salah satu alasan pemadaman listrik saat banjir adalah karena takut listrik terbawa air, apakah semua bentuk air atau larutan bisa menghantarkan listrik? Bagaimana dengan air cuka? Air gula? Atau air asin?
Selama ini kita mengira pembawa air ada semua jenisnya, namun pada tahun 2016 dilansir oleh
Perhatikan Data Berikut!larutan Nyala Lampu Gelembung G
Science Alert, berdasarkan penelitian yang dipimpin oleh Mark Johnson dari Universitas Yale, mencatat bahwa air murni sebenarnya tidak menghantarkan listrik karena kurangnya elektron bebas.
Namun sebagian besar air di atmosfer kita bercampur dengan berbagai sedimen dan mineral yang kemudian mengionisasi molekul air sehingga memungkinkan untuk menghantarkan listrik, sehingga air atau H2O merupakan salah satu contoh larutan elektrolit lemah.
Pertama, pengertian kata “larutan”, dimana larutan bukanlah air, melainkan campuran homogen yang terdiri dari dua zat atau lebih.
Larutan homogen berarti larutan tersebut mempunyai komposisi yang seragam atau setiap bagian volumenya mempunyai komposisi atau sifat yang sama.
Percobaan Pengujian Larutan Dengan Alat Uji Elektrolit Didapatkan Hasil Sebagai Berikut.berdasarkan Data
Zat yang terdapat dalam jumlah sedikit disebut zat terlarut atau zat terlarut dan zat yang terdapat dalam jumlah lebih banyak dibandingkan zat lain disebut pelarut.
Ada beberapa jenis larutan antara lain larutan elektrolit dan larutan non elektrolit yang akan saya bahas dibawah ini.
Apa itu Larutan Elektrolit Anda dapat dengan mudah menjawab pertanyaan jika larutan elektrolit adalah larutan yang mengandung partikel berbentuk ion yang dapat menghantarkan listrik.
Dari penjelasan singkat di atas, mungkin Anda bertanya-tanya mengapa larutan elektrolit bisa menghantarkan listrik. Melalui mekanisme manakah arus listrik ditransfer melalui larutan elektrolit?
Belajar Pintar Materi Smp, Sma, Smk
Berdasarkan proses pembentukan ionnya (ionisasi), larutan elektrolit dibedakan menjadi 2 jenis, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
Karena sifat tersebut, larutan yang dapat menghantarkan listrik merupakan larutan terbaik yang termasuk dalam kelompok larutan elektrolit kuat.
Larutan elektrolit kuat ditandai dengan ionisasi sempurna sehingga membentuk ion bebas ketika larutan larut dan tidak terbentuk molekul netral dalam larutan.
Lalu apa saja contoh larutan elektrolit kuat? Mungkin sebagian dari Anda bertanya-tanya apakah garam meja termasuk elektrolit atau bukan?
A. Manakah Larutan Yang Merupakan Elektrolit Kuat!b. Manakah Larutan Yang Merupakan Elektrolit Lemah!c.
Jawabannya, garam meja merupakan elektrolit kuat karena garam tersebut mengandung molekul yang bila dilarutkan dapat terionisasi dan hal ini akan membuat larutan mempunyai kemampuan menghantarkan listrik.
Garam meja padat tidak dapat menghantarkan listrik, tetapi ketika garam tersebut larut, ion-ionnya dapat bergerak bebas dalam larutan sehingga memungkinkan muatan mengalir. Sementara itu, ion garam dalam wujud padat terikat oleh gaya antarpartikel yang kuat. Oleh karena itu, mereka tidak bebas bergerak dalam keadaan padat dan tidak dapat menghantarkan listrik.
Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong larutan elektrolit kuat. Karena banyak larutan yang dapat menghantarkan listrik, seperti NaOH (soda api), H2SO4 (asam sulfat), HCl (asam klorida), dan KCl, maka larutan tersebut juga merupakan elektrolit kuat.
Karakteristik larutan elektrolit lemah adalah ia hanya terionisasi sebagian dalam air (biasanya 1% hingga 10%). Oleh karena itu, elektrolit lemah tidak seefisien elektrolit kuat dalam menghantarkan listrik.
Larutan Elektrolit Dan Non Elektrolit, Ini Contoh Dan Perbedaannya!
Zat dalam larutan elektrolit lemah biasanya meliputi asam lemah dan basa lemah yang sebagian besar merupakan senyawa kovalen. Larutan elektrolit lemah ini mengandung sedikit molekul netral.
Air juga merupakan elektrolit yang sangat lemah. Ionisasi air murni dapat direpresentasikan dengan persamaan ionisasi H2O → H+ + OH-.
Elektrolit kuat mempunyai kecenderungan lebih baik untuk menambahkan ion dibandingkan elektrolit lemah karena dalam larutan elektrolit kuat semua senyawa yang terionisasi membentuk ion. Sedangkan elektrolit lemah hanya sebagian saja yang terionisasi, sehingga elektrolit kuat merupakan penghantar listrik yang lebih baik.
Pada pembahasan sebelumnya kita telah mengetahui bahwa larutan yang dapat menghantarkan listrik adalah larutan elektrolit, namun apa yang dimaksud dengan larutan non elektrolit?
Solved: Tolong Dijawab Ya Kak No. 1 10 Uji Kompetensi Bab V Soal Pilihan Ganda Di Bawah Ini Yang Bukan Merupakan Larutan Adalah Garam Dicampur Dengan Air Urca Dicampur Dengan Air Asam Cuka
Berbeda dengan larutan elektrolit, larutan non-elektrolit merupakan larutan yang tidak dapat menghantarkan listrik karena zat terlarutnya tidak membentuk ion atau terionisasi sama sekali.
Contoh lainnya adalah glukosa dalam air yang membentuk larutan non-elektrolit karena gula tetap mempertahankan identitas kimianya meskipun dilarutkan dalam air.
Gambar di atas merupakan contoh perbedaan jumlah molekul ion antara elektrolit kuat, elektrolit lemah, dan nonelektrolit.
Jika larutan non-elektrolit tidak membentuk ion-ion yang bergerak bebas maka tidak akan menghantarkan listrik, sedangkan larutan elektrolit kuat dan lemah mengandung ion-ion yang bergerak bebas.
Larutan Berikut Yang Merupakan Pasangan Elektrolit Kuat Dan Nonelektrolit Secara Berturut
Meskipun larutan elektrolit lemah tidak menghasilkan ion sebanyak elektrolit kuat, dapat dikatakan bahwa lilin yang menyala dalam elektrolit lemah tidak sekuat atau terbakar lebih lemah dibandingkan lilin dalam elektrolit kuat.
Nah untuk menguji pemahaman Anda terhadap ketiga jenis solusi tersebut, saya punya contoh soal yang bisa Anda baca lengkap dengan pembahasannya:
Jadi jawaban dari pertanyaan golongan senyawa berikut yang dalam larutan dapat menghantarkan listrik adalah zat yang dapat terionisasi sempurna dan dapat digolongkan dalam asam kuat, basa kuat atau garam yaitu : H
Untuk memudahkan Anda mengingatnya, berikut tabel contoh larutan elektrolit kuat dan lemah serta larutan non elektrolit:
Solution: Soal Kimia S 2 Kelas 10 Kendedes
Konduktivitas suatu larutan menunjukkan adanya ion-ion bermuatan listrik yang dapat bergerak bebas di dalam larutan. Sedangkan larutan non-elektrolit memiliki potensi tersebut.
Ketika suatu zat yang terionisasi dapat bergerak bebas dalam larutan, maka memungkinkan muatan mengalir dengan bebas, sehingga aliran muatan ideal sebagai penghantar arus. Oleh karena itu larutan elektrolit disebut larutan yang dapat menghantarkan arus listrik.
Sedangkan larutan non elektrolit adalah senyawa yang tidak terionisasi sama sekali dalam larutan, tidak ada ion dalam larutan, zat hanya berupa molekul yang tidak bermuatan listrik. Kurangnya aliran muatan dari pergerakan ion berarti larutan tanpa elektrolit tidak dapat menghantarkan listrik.
Jadi jawaban dari pertanyaan diatas adalah air laut dapat menghantarkan listrik lebih baik dibandingkan air suling dan air gula.
Bantu Jalannya Dong Please
Berdasarkan pembentukan ikatan ionik dalam larutan, senyawa yang mengandung elektrolit merupakan senyawa ionik dan kovalen polar, sedangkan senyawa yang mengandung nonelektrolit adalah senyawa yang ikatannya terbentuk dari senyawa kovalen nonpolar.
Sesuai dengan namanya, senyawa ini mengandung ion-ion yang bergerak bebas dalam suatu pelarut, misalnya larutan NaCl yang mengandung ion Na+ dan ion Cl-.
Senyawa NaCl hanya dapat menghantarkan listrik jika dilarutkan atau dicairkan, jika berbentuk kristal atau padat maka NaCl tidak dapat menghantarkan listrik, karena ion-ionnya tidak dapat bergerak bebas.
Senyawa kovalen bersifat polar bila dilarutkan dalam air, karena air merupakan pelarut polar. Gaya tarik menarik antara molekul air dan molekul zat terlarut akan cukup kuat untuk memutuskan ikatan antarmolekul tertentu dan membentuk ion.
Soal Revisi Asesmen Pendidikan
Oleh karena itu dapat disimpulkan bahwa hanya senyawa kovalen polar yang dapat menghantarkan listrik dalam bentuk larutan, sedangkan dalam bentuk cair dan padat tidak dapat menghantarkan listrik.
Contoh larutan yang merupakan bagian dari senyawa kovalen polar adalah larutan HCl atau biasa disebut larutan asam klorida.
Untuk memudahkan anda mengingat dan memahaminya, dibawah ini anda dapat membuat tabel perbedaan elektrolit pada senyawa ionik, kovalen polar, dan kovalen non polar.
Derajat ionisasi merupakan parameter suatu larutan elektrolit yang berupa perbandingan antara jumlah zat pengion dengan jumlah zat induk, maka digunakan persamaan sebagai berikut:
Diketahui Tiga Jenis Larutan Beserta Spesinya Berikut. Pe
Meski terdengar asing ditelinga kita, dan jarang digunakan dalam komunikasi sehari-hari, nyatanya manfaat larutan elektrolit dan non elektrolit banyak digunakan dalam kehidupan sehari-hari.
4. Tulang dan Sel Magnesium ditemukan di otot, tulang, sistem saraf dan berperan dalam banyak reaksi biokimia.
Contoh larutan elektrolit dalam kehidupan sehari-hari adalah ketika Anda melihat iklan minuman menyegarkan yang efektif menghilangkan dehidrasi. Minuman menyegarkan ini dirancang untuk menyeimbangkan keseimbangan ion tubuh.
Dehidrasi merupakan kondisi tubuh kekurangan cairan sehingga perlu mengonsumsi cairan atau larutan oralit. Cairan oralit merupakan cairan yang terdiri dari air, gula dan garam dan biasa digunakan untuk mencegah dehidrasi pada manusia.
Elektrolit Dan Non Elektrolit
Berikut ini yang merupakan iklan online adalah, berikut ini yang merupakan penyakit saluran pernapasan adalah, berikut ini yang merupakan masalah sosial adalah, berikut ini yang merupakan mukjizat nabi musa alaihissalam adalah, berikut ini yang merupakan kelemahan website builder adalah, berikut ini yang merupakan penyebab penyakit maag adalah, berikut ini yang merupakan pemain sepak bola adalah, larutan elektrolit yang merupakan senyawa ion, berikut ini yang merupakan kegiatan distribusi adalah, berikut ini yang merupakan lagu keroncong adalah, berikut ini yang merupakan jenis ikan air tawar adalah, berikut ini yang merupakan contoh perubahan yang berbentuk progres adalah